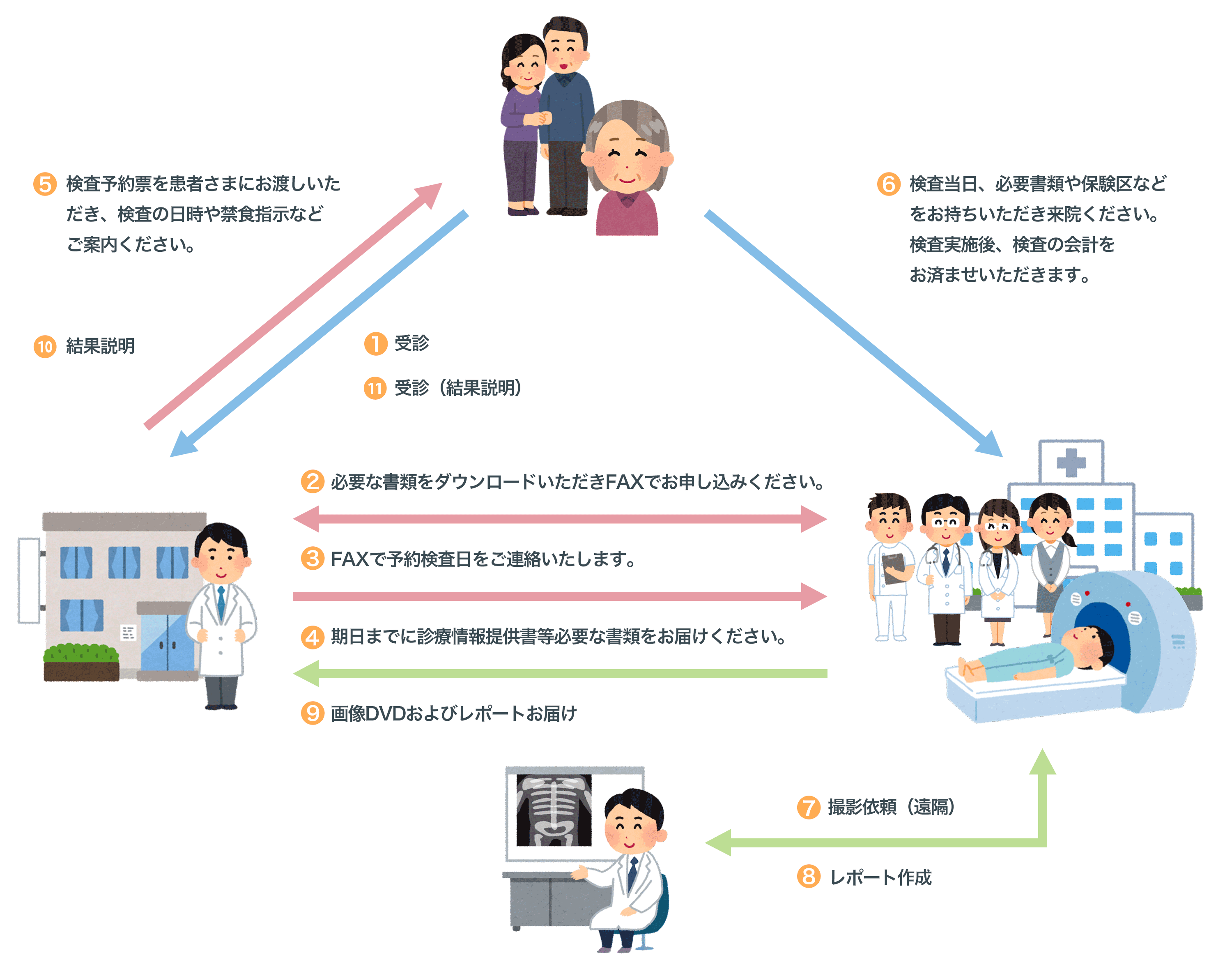
糸魚川総合病院では地域医療連携の一環として、各種放射線検査のご依頼を地域医療連携室を窓口としてお受けしております。申込み手順、必要な書類のダウンロードなどは以下の説明をご覧ください。
お引き受けできる放射線検査
- CT検査(造影なし、造影あり※1)
- MRI検査(造影なし、造影あり※1)
- 骨密度検査※2
- マンモグラフィー検査※2
- ダイナミック検査はご予約いただけません。詳しくは注意事項をお読みください。
- 読影依頼不可の検査となります。
各種放射線検査 申込み手順概略
手順の詳細はこちらへ。
- 必要な書類をダウンロードしてお手元にご用意ください。
- 放射線検査申込書に必要事項をご記入いただき、地域医療連携室までFAXにて送信してください。
予約検査日時および診療情報提供書の提出期限日を記入し、返信いたします。 - 診療情報提供書、造影剤を使用する検査では造影剤使用についての問診票兼同意書をご記入いただき、提出期限内に地域医療連携室までお届けください。
放射線科医師(非常勤)が指示内容を確認します。
指示内容に変更が生じた際には、検査内容変更連絡票をFAXいたします。
重要造影剤を使用する検査では、直近3ヶ月以内のeGFR値もしくは血清クレアチニン値が記入された同意書が必要です。 - 検査予約票に必要事項をご記入いただき、患者さまには当日のご案内や結果説明日などのご説明をお願いいたします。
- 後日、DVDと(あれば)読影レポートをお届けいたします。
放射線検査申込み手順詳細
1.ご予約の前に・書類のダウンロード
検査申込書・診療情報提供書および各検査の必要な書類を、ダウンロードしてお手元にご用意ください。
- 毎回ダウンロードいただく必要はございません。ダウンロードした書類を複写の上ご利用いただいても結構です。
- 診療情報提供書については、各ご施設で通常使用されている書式を用いていただいても結構です。
- 診療情報提供書や造影剤使用同意書など控えが必要な書類については、記入後依頼元ご施設で複写してください。
- 骨密度検査およびマンモグラフィー検査では診療情報提供書は不要です。
検査申込書
| CT/MRI/マンモグラフィー/骨密度検査申込書 | 1枚 | Word |
|---|
診療情報提供書
| 診療情報提供書 | 1枚 | Word |
|---|
単純CT
| 一括ダウンロード | Word | ||
|---|---|---|---|
| CT検査予約票 | 1枚 | Word |
造影CT
| 一括ダウンロード | Word | ||
|---|---|---|---|
| CT検査予約票 | 1枚 | Word | |
| ヨード造影剤説明用紙 | 2枚 | Word | |
| ヨード造影剤問診票/同意書 | 1枚 | Word |
単純MRI
| 一括ダウンロード | Word | ||
|---|---|---|---|
| MRI検査予約票 | 1枚 | Word | |
| チェックシート | 1枚 | Word |
造影MRI
| 一括ダウンロード | Word | ||
|---|---|---|---|
| MRI検査予約票 | 1枚 | Word | |
| チェックシート | 1枚 | Word | |
| ガドリニウム造影剤説明用紙 | 2枚 | Word | |
| ガドリニウム造影剤問診票/同意書 | 1枚 | Word |
マンモグラフィー/骨密度
| マンモグラフィー/骨密度 | 1枚 |
|---|
依頼放射線検査に関する注意事項(必ずお読みください)
2.ご予約
- 予めダウンロードした「検査申込書」に必要事項および(あれば)ご希望の日時をご記入の上、FAXで地域医療連携室まで送信してください。
- 予約の空き状況、必要事項の内容を地域医療連携室担当者が確認します。
- ご希望の日時に予約が可能な場合、担当者より「検査申込書」に検査日時、「診療情報提供書」の提出期限を記入し、FAXで連絡いたします。
- ご希望の日時に予約を取得することが難しい場合は、担当者より予約時間調整の電話連絡をさせていただきます。
- 被ばくを伴う検査については、患者さまに放射線被ばくについての説明をお願いします。その後申込書の説明実施欄のチェックボックスにチェックを入れてください。
糸魚川総合病院 地域医療連携室
- TEL
- 025-552-0280(内線 1362)
- FAX
- 025-552-0815
- 受付時間
- 平日午前8:30~午後5:00(祝祭日を除く)
- 急用による検査のキャンセルなど、上記時間外は025-552-0280(代表)へご連絡ください。
- FAX送信の際は誤送信にご注意願います。個人情報漏洩の危険や申込み未受理となる場合がございます。
3.ご予約後
ご予約後は、患者さまに検査日時や持参書類、禁食などの検査注意事項、結果説明日などをご説明いただきます。
1. 診療情報提供書および(造影の方のみ)問診票/同意書の記入と提出
- 診療情報提供書(ダウンロードした書式もしくは依頼元医療機関で通常使用されている書式のいずれでも結構です)をご記入いただき、返信された検査申込書に記載された期限内に、地域医療連携室までお届けください。
- 「造影あり」の検査を申し込まれた場合、ヨード造影剤、ガドリニウム造影剤、それぞれに用意された書式の造影剤使用についての問診票/同意書が必要となります。各造影剤の説明書にもとづきご説明いただき、問診聴取をお願いします。患者さまには同意するか否かに〇をふっていただき、ご本人もしくは代理人署名を頂いてください。依頼医師は、直近3ヶ月以内の血清クレアチニン値もしくはeGFR値をご記入の上、依頼医師としての造影可否判断欄にチェックを入れていただき、依頼医師署名をお願いいたします。必要事項をご記入いただいた問診票/同意書は2部複写いただき、1部は患者さま控えとして患者さまにお渡しいただき、もう1部は依頼元の医療機関さまで保管してください。
問診票/同意書の原本は診療情報提供書と併せ、地域医療連携室までお届けください。- 依頼放射線検査に関する注意事項をご一読ください。
- ご提供いただいた診療情報提供書の内容や(あれば)問診票/同意書を、放射線科医師(非常勤)が確認させていただきます。放射線科医師の判断で検査の修正や変更をご提案させていただく場合があります。変更がある場合、変更内容を検査内容変更連絡票に記載し、FAXにて送信いたします。
2. 各検査の予約票の記入と患者さまへのご案内
- ダウンロードいただいた検査予約票に、検査日時や(あれば)禁食指示などをご記入ください。患者さまにはこれらに加え、来院時刻や持参書類などのご説明をお願いいたします。なお、CT、MRI検査では体重情報が必要ですので、体重記載欄に体重をご記入ください。ご案内後には検査予約票を患者さまにお渡しください。
- 骨密度検査およびマンモグラフィー検査に予約票はありませんので、ご予約日時をお伝えください
- 検査結果の説明日のご案内をお願いします。読影レポートおよび画像DVDは通常5診療日以内にお届けします。
3. MRI安全チェックシートの記入(MRI検査のみ)
- 手術歴などをご確認いただき、禁忌事項や注意事項に該当項目が無いかをシートにご記入ください。
- ご記入後、MRI検査の可否をご判断いただき、依頼医師の確認署名をお願いします。
- 装飾品や外すことができる金属類については、検査当日に担当技師が確認をしますが、予めできるだけ装飾品や金属類をお外しいただいた状態での来院をご説明願います。
- ご記入いただいたチェックシート原本は、診療情報提供書と併せお届けください。必要であれば複写の上保管をお願いします。
4.検査当日
- お渡しした書類や、患者さまへの案内用紙に記載された、その他のお持ちいただくもの(保険証など)をお持ちいただき、指定された時間までに糸魚川総合病院 受付までお越しください。
- 当日ご都合の悪い方は必ず前もってご連絡ください。
糸魚川総合病院 地域医療連携室
- TEL
- 025-552-0280(内線 1362)
- FAX
- 025-552-0815
- 受付時間
- 平日午前8:30~午後5:00(祝祭日を除く)
- 急用による検査のキャンセルなど、上記時間外は025-552-0280(代表)へご連絡ください。
- FAX送信の際は誤送信にご注意願います。個人情報漏洩の危険や申込み未受理となる場合がございます。
5.検査後
- 依頼された放射線検査につきましては、検査後に特別な指示がなければ通常の生活を送っていただいてかまいませんが、造影剤を使用した検査の場合、排泄を促すよう水分(水やお茶、スポーツドリンク)を摂取していただくようお願いしています。
- 造影剤を使用した検査の場合、稀に検査後数時間~数日経ってから痒みや蕁麻疹などの軽度の副作用(遅発性副作用)が出現することがあります。このような場合は上記連絡先までご一報ください。
6.結果報告
- 通常5診療日以内に読影レポートをお届けします。
- GW、お盆、正月期間はこの限りではございません、予めご了承ください
